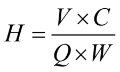تليين وتجديد راتنج التبادل الأيوني
راتنج التبادل الأيونيمركب بوليمر غير قابل للذوبان في الأحماض ، المحاليل القلوية ، والمذيبات العضوية. لديها استقرار فيزيائي وكيميائي عالي وهي مادة مهمة تستخدم في معالجة المياه والفصل الكيميائي والفصل البيولوجي وغيرها من المجالات. مبدأها هو استخدام المجموعات الوظيفية الأيونية على الراتنج للتفاعل كيميائيًا مع الأيونات في المحلول ، وبالتالي تحقيق فصل وتنقية الأيونات.
هيكل
العناصر التي تشكل راتنج التبادل الأيوني هي بشكل عام الكربون والهيدروجين والأكسجين والنيتروجين والكبريت. الوحدات المكونة هي العمود الفقري البوليمر ، مجموعات وظيفية تعلق على العمود الفقري وأيونات قابلة للتبديل في المجموعات الوظيفية. العمود الفقري للبوليمر عبارة عن هيكل شبكي متعدد الأبعاد ثلاثي الأبعاد مع سلاسل بوليمر مترابطة ومتشابكة ، ولا تشارك في تفاعلات التبادل الأيوني ، والسلاسل عبارة عن مجموعات وظيفية مشحونة بأيونات بشحن معاكس تسمى أيونات قابلة للتبديل أو أيونات مضادة. لا يمكن أن تتحرك المجموعات الوظيفية والعمود الفقري للبوليمر بحرية ، ولكن يمكن لأيونات العداد أن تنفصل إلى أيونات تتحرك بحرية في المحلول. القدرة على التبادل مع أيونات العداد الأخرى بنفس الشحنة من الخارج في ظل ظروف معينة وعملية التفكك أو القرار قابلة للعكس ، مما يحدد أداء التبادل الأيوني للراتنج.
عملية التشكيل والبنية الكيميائية لراتنج التبادل الكاتيون الحامض القوي
لماذا نحتاج الراتنج ؟
سوف تسبب صلابة المياه المفرطة الكثير من الإزعاج للعديد من الصناعات. على سبيل المثال ، في المياه المنزلية ، تقلل صلابة المياه الزائدة من طعم مياه الشرب ، وفي الحالات الخطيرة ستؤثر على صحة الإنسان. في إمدادات مياه الغلايات ، ستولد أيونات الصلابة في الماء أيضًا مقياس المرجل في المرجل ، والذي لا يهدر الوقود فحسب ، بل يتسبب أيضًا في الانفجارات. في مجال تحلية مياه البحر ، لا يوجد فقط عدد كبير من نا+، ك+، Cl-, شارك32-، وهكذا42-، ولكن أيضا تركيز عال من كاليفورنيا2 +و Mg2 +بدون أي علاج ، سوف يعجل عددًا كبيرًا من الرواسب ويسبب تقشير لا رجعة فيه داخل النظام ، مما يقلل من معدل استرداد المياه وثبات التشغيل ، وبالتالي يزيد من تكاليف التشغيل. لذلك ، سواء من منظور سلامة المياه المنزلية أو نظام تحلية المياه مانع للقاذورات وتثبيط النطاق ، فمن الحتمي التحكم في صلابة المياه ضمن نطاق معين.
عملية تليين وتجديد الراتينج الأيوني
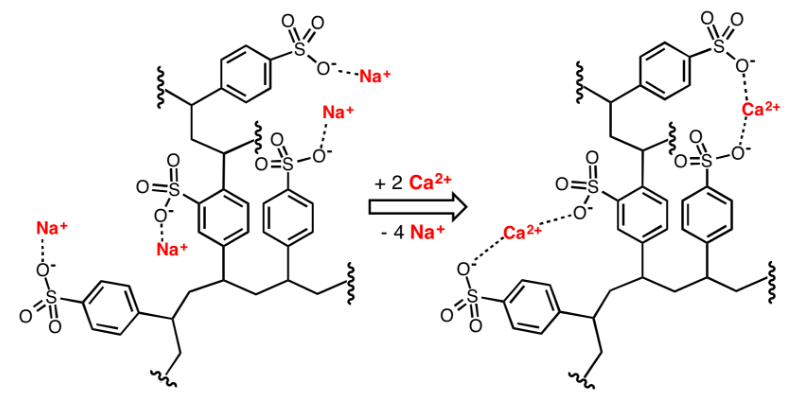
الأيونات القابلة للتبديل التي يتم حملها على الراتنج الأيوني المستعمل لتليين المياه عادة ما تكون غير قابلة للتبديل+و H+، والتي يمكن أن تتفاعل مع كاليفورنيا2 +و Mg2 +في الحل. راتنج التبادل الأيوني من نوع Na ، على سبيل المثال ، في المحلول في درجة حرارة الغرفة وتركيزه المنخفض ، بسبب التقارب الأقوى بين كاليفورنيا2 +(أو ملغ2 +) وراتنج التبادل الأيوني ، رد الفعل على اليمين ، نا+في يتم استبدال الراتنج باستمرار كاليفورنيا2 +(أو ملغ2 +حتى توازن التفاعل ؛ عندما تركيز نا+في المحلول أكبر (أي ، يضاف الراتنج إلى محلول ملحي مشبع أو محلول HCl) ، يتم إجراء التفاعل بالكامل إلى النقطة التي يكون فيها تركيز Na+في المحلول أكبر (أي ، يضاف محلول ملحي مشبع أو محلول HCl إلى الراتنج) ، وسينتقل التفاعل بالكامل إلى اليسار ، أي ، كاليفورنيا2 +(أو ملغ2 +) في الراتنج يتم تمديده باستمرار لتجديد راتنج التبادل الأيوني.
تليين وتجديد نا+راتنج الصرف
حساب دورة تجديد الراتنج
تشير دورة تجديد الراتنج إلى الوقت المستخدم عندما يفقد راتنج التبادل قدرته على الامتصاص تدريجيا بعد فترة من الاستخدام ويصل إلى حالة التشبع. تتأثر دورة التجديد بالعديد من العوامل مثل تدفق المياه ، صلابة المياه الكلية ، اختيار الراتنج ، إلخ.
وفقًا لحجم خزان تنقية المياه ، احسب حجم ملء الراتنج ، والذي يكون عمومًا 60% إلى 90% من ارتفاع خزان تنقية المياه.
يمكننا العثور على دورة التجديد على النحو التالي: 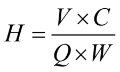
يمكن أيضًا الحصول على إنتاج المياه الدوري على النحو التالي: 
- دورة تجديد — (ساعة)
- Qج— إنتاج المياه الدوري (m3)
- V — حجم الراتنج (m3)
- ج — قدرة التبادل العاملة (مليمول/لتر)
- معدل تدفق المدخل Q — (m3/ح)
- W — مجموع صلابة المياه (مليمول/لتر)
على سبيل المثال ، عندما Q = 40 m3/ساعة ؛ V = 2 متر3; C = 800 مللي مول/لتر; W = 5 مللي مول/لتر ، ثم H = 2 × 800 ÷ (40 × 5) = 8 ساعات ، و Qج= 2 × 800 ÷ 5 = 320 م3.
استهلاك الملح المعاد تدويره
يحتاج الراتنج إلى إعادة التوليد مع الملح والأحماض والقلويات المقابلة بعد الفشل في استعادة قدرته على العمل ، ويستخدم استهلاك التجدد ونسبة التجدد لقياس قدرة الراتنج على التجدد. استهلاك التجدد = نسبة التجدد × الكتلة المولية ، لذلك دورة استهلاك الملح = نسبة التجدد × الكتلة المولية (جم/مول) × سعة تبادل العمل (مول/لتر) × حجم ملء الراتنج (لتر).